利用“烧杯法”计算溶液的质量
来源:网络收集 点击: 时间:2024-09-07【导读】:
九年级化学计算中常把有关溶液的计算融入到根据化学方程式的计算当中,对于这类题型,有关溶液的计算是根据化学方程式计算的突破口,而溶液质量的计算则是解题的关键,也是解综合计算题的难点所在。利用“烧杯法”计算溶液的质量,简便、直观、好用、准确率高,下面与你分享。工具/原料more计算题、草稿纸、笔例题解析1/4分步阅读 2/4
2/4 3/4
3/4 4/4
4/4
 变式训练11/4
变式训练11/4 2/4
2/4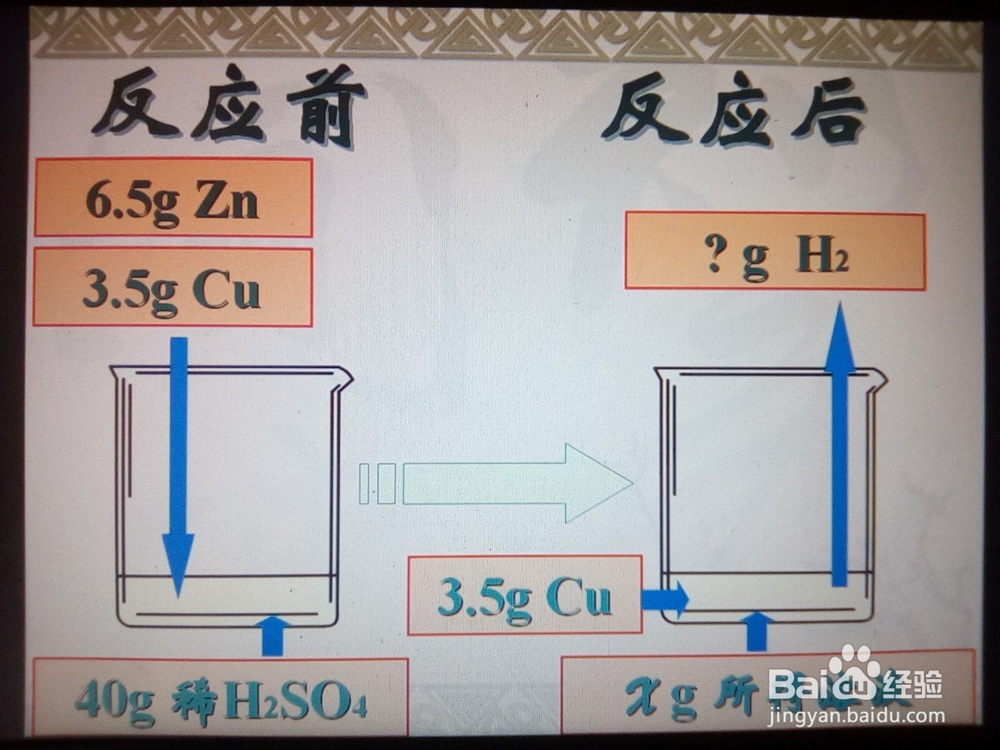 3/4
3/4 4/4
4/4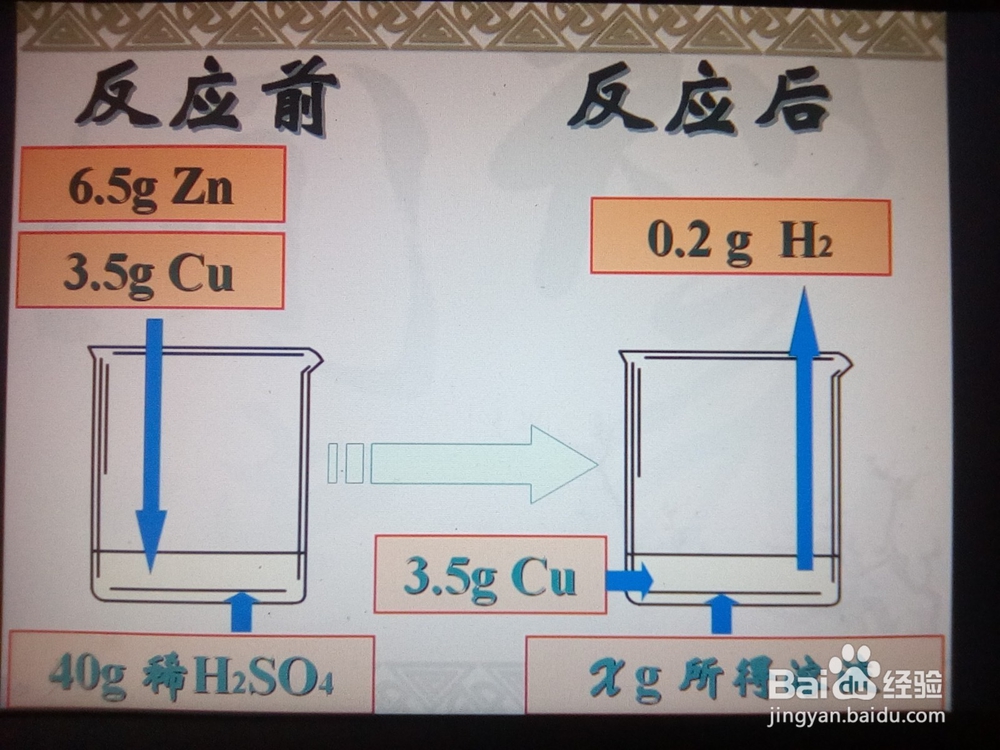
 变式训练21/3
变式训练21/3 2/3
2/3 3/3
3/3 注意事项
注意事项
审题:反应前、反应后的溶液分别是什么,质量是多少?
 2/4
2/4分析:发生了哪些化学反应?
反应前有哪些物质放入溶液中,质量是多少?
反应后有哪些物质跑出溶液,质量是多少?
 3/4
3/4计算H2的质量:根据化学方程式计算出6.5gZn和H2SO4反应所得H2的质量。
 4/4
4/4计算所得溶液的质量:反应前放入溶液的物质的质量+溶液的质量=反应后跑出溶液的物质的质量+所得溶液的质量。

 变式训练11/4
变式训练11/4审题:反应前、反应后的溶液分别是什么,质量是多少?
 2/4
2/4分析:黄铜中Zn与稀H2SO4反应,Cu不反应;因稀H2SO4足量,故Zn反应完全;剩余固体为Cu,质量3.5g,则参加反应的Zn为10—3.5=6.5(g)。
 3/4
3/4计算H2的质量:根据化学方程式计算出6.5gZn和H2SO4反应所得H2的质量。
 4/4
4/4计算所得溶液的质量:反应前放入溶液的物质的质量+溶液的质量=反应后跑出溶液的物质的质量+所得溶液的质量。

 变式训练21/3
变式训练21/3审题,同变式训练1,利用“烧杯法”解出所得溶液的质量。
 2/3
2/3根据化学方程式利用参加反应的Zn的质量计算出所得溶液中ZnSO4的质量。
 3/3
3/3利用公式:溶质的质量分数 = 溶质的质量 / 溶液的质量 x100% 求解。
 注意事项
注意事项“烧杯法”的实质就是反应前后物质的质量守恒。
“烧杯法”运用时不能把气体或沉淀的质量算入所得溶液的质量当中。
版权声明:
1、本文系转载,版权归原作者所有,旨在传递信息,不代表看本站的观点和立场。
2、本站仅提供信息发布平台,不承担相关法律责任。
3、若侵犯您的版权或隐私,请联系本站管理员删除。
4、文章链接:http://www.1haoku.cn/art_1195844.html
上一篇:简笔画熊二的画法
下一篇:支付宝如何绑定银行卡
 订阅
订阅