焓变计算公式
来源:网络收集 点击: 时间:2024-02-241、从宏观角度:焓变(△H):ΔH=H生成物-H反应物(宏观),其中:
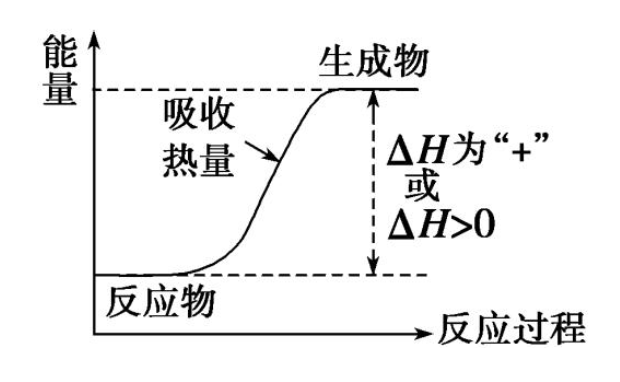
H生成物表示生成物的焓的总量;H反应物表示反应物的焓的总量;ΔH为“+”表示吸热反应,ΔH为“-”表示放热反应。
2、从微观角度:ΔH=E吸收-E放出(微观),其中:E吸收表示反应物断键时吸收的总能量,E放出表示生成物成键时放出的总能量;ΔH为“+”表示吸热反应,ΔH为“-”表示放热反应。
常用计算方法:
(1)根据热化学方程式进行计算:焓变与反应物各物质的物质的量成正比;
(2)根据反应物和生成物的总焓计算:ΔH=H(反应产物)-H(反应物);
(3)依据反应物化学键断裂与生成物化学键形成过程中的能量变化计算:ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量;
(4)根据盖斯定律的计算;
(5)根据比热公式求算:Q=-c·m·ΔT。
扩展资料
(1)反应焓变的数值与各物质的系数成正比。因此热化学方程式中各物质的系数改变时,其反应焓变的数值需同时做相同倍数的改变。
(2)正、逆反应的反应热焓变的数值相等,符号相反。
(3)热化学方程式与数学上的方程式相似,可以移项同时改变正负号,各项的系数包括ΔH的数值可以同时扩大或缩小相同的倍数。
(4)多个热化学方程式可以相加或相减,ΔH也进行相应的相加或相减,得到一个新的热化学方程式。
(5)热化学方程式中的反应焓变是指反应按照所给形式进行完全时的反应焓变。
参考资料来源:百度百科-反应焓变
参考资料来源:百度百科-焓变
版权声明:
1、本文系转载,版权归原作者所有,旨在传递信息,不代表看本站的观点和立场。
2、本站仅提供信息发布平台,不承担相关法律责任。
3、若侵犯您的版权或隐私,请联系本站管理员删除。
4、文章链接:http://www.1haoku.cn/art_143360.html
 订阅
订阅