磁量子数m怎么确定
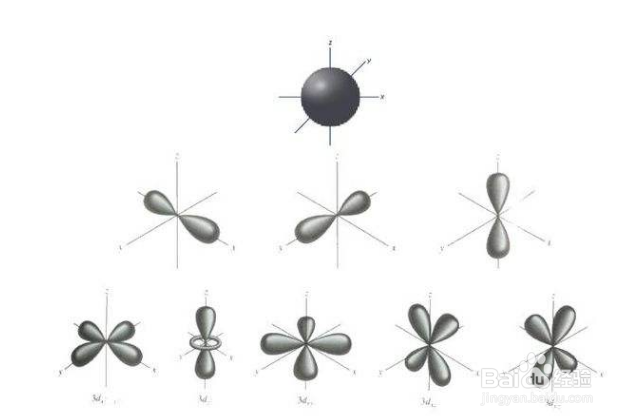
来源:网络收集 点击: 时间:2024-03-31第一步 原子轨道符号的表示如下:1、当n=3,l=2,m=0时,原子轨道符号为3dz²。2、当n=3,l=2,m=+1时,原子轨道符号为3dxz。3、当n=3,l=2,m=-1时,原子轨道符号为3dyz。4、当n=3,l=2,m=+2时,原子轨道符号为3dxy。5、当n=3,l=2,m=-2时,原子轨道符号为3dx²-y²。
 2/4
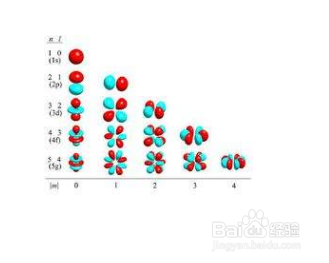
2/4下一步在现代量子力学模型中,描述电子层的量子数称为主量子数(principal quantum number)或量子数n,n的取值为正整数1、2、3、4、5、6、7,对应符号为K、L、M、N、O、P、Q。对氢原子来说,n一定,其运动状态的能量一定。一般而言:n越大,电子层的能量越高。对于每一个电子层对应的主量子数n,l的取值可以是0、1、2、n-1,也就是说,总共有n个能级,因为第一电子层K的n=1,所以它只有一个能级,而n=2的L层就有两个能级,表现在光谱上就是两条非常相近的谱线。
 3/4
3/4下一步从第一到第七周期的所有元素中,人们共发现4个能级,分别命名为s,p,d,f。从理论上说,在第八周期将会出现第五个能级。
 4/4
4/4下一步电子运动描述轨道的量子数称为磁量子数(magnetic quantum number)符号“m”,对于每一个确定的能级(电子亚层),m有一个确定的值,这个值与电子层无关(任何电子层内的能级的轨道数相同)。磁量子数m取值受角量子数l制约,对于给定的l值,m∈{m|m∈Z且|m|≤l} 既m= -l,...,-2,-1,0,+1,+2…+l,共2l+1个值。这些取值意味着在角量子数为l的亚层有2l+1个取向,而每一个取向相当一条“原子轨道”。
 总结1/3
总结1/3原子轨道符号的表示如下:1、当n=3,l=2,m=0时,原子轨道符号为3dz²。2、当n=3,l=2,m=+1时,原子轨道符号为3dxz。3、当n=3,l=2,m=-1时,原子轨道符号为3dyz。4、当n=3,l=2,m=+2时,原子轨道符号为3dxy。5、当n=3,l=2,m=-2时,原子轨道符号为3dx²-y²。
2/3在现代量子力学模型中,描述电子层的量子数称为主量子数(principal quantum number)或量子数n,n的取值为正整数1、2、3、4、5、6、7,对应符号为K、L、M、N、O、P、Q。对氢原子来说,n一定,其运动状态的能量一定。一般而言:n越大,电子层的能量越高。对于每一个电子层对应的主量子数n,l的取值可以是0、1、2、n-1,也就是说,总共有n个能级,因为第一电子层K的n=1,所以它只有一个能级,而n=2的L层就有两个能级,表现在光谱上就是两条非常相近的谱线。
3/3从第一到第七周期的所有元素中,人们共发现4个能级,分别命名为s,p,d,f。从理论上说,在第八周期将会出现第五个能级。
注意事项磁量子数知识运用
原子轨道知识运用
版权声明:
1、本文系转载,版权归原作者所有,旨在传递信息,不代表看本站的观点和立场。
2、本站仅提供信息发布平台,不承担相关法律责任。
3、若侵犯您的版权或隐私,请联系本站管理员删除。
4、文章链接:http://www.1haoku.cn/art_389915.html
 订阅
订阅