电子式如何书写
来源:网络收集 点击: 时间:2024-04-18一、怎样书写电子式
1.原子电子式的书写要符合孤对电子的情况,有利于学习化学键。
由于原子最外层为nsnp,一个s轨道,三个p轨道,共可容纳8个电子,故可将元素符号的上下左右看成四个轨道,再分别按洪特规则填以实有的电子数。现以第2周期八种元素为例,其电子式的写法如下:
这里注意的是,镁、铝、硅、磷、硫原子的电子式不应该写成如下形式:
因为Mg为3s2,Al为3s23p1,Si为3s23P3PP,P为3s23P3P3P。
 2/3
2/32.离子电子式的书写主要是阴离子要有方括号和离子电荷。离子电荷标在右上角,且数字在前,正负号在后。如果标在正上方,且正负号在前,符号在后,则是标能化合价符号了。阳离子除铵根离子外,一般只在元素符号的右上角标出数字和正号,而不再标出最外层电子。
主族元素的原子,除氢原子外,一般最外层都是8电子的稳定结构。
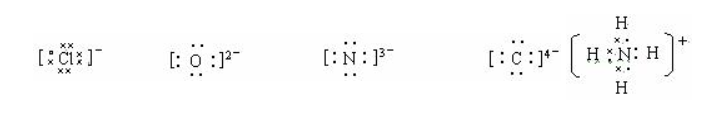 3/3
3/33.分子或共价化合物电子式的书写,要注意共价键是非极性键还是极性键;若果是非极性键,则共用电子对应处于两原子的中间;若是极性共价键,则共用电子对应偏向于吸引电子能力大(即非金属性较强)的原子,而偏离吸引电子能力小(即非金属性较弱)的原子。
还要注意两原子间是共用一对电子,还是共用两对、叁对电子。如N2和CO2分子的电子式书写容易出错,可从下列书写方式加深对它们电子式的理解。
从以上形成共用电子对的过程可知,N2分子中是共价叁键,而非两个三电子键。
对于CO2分子情况要复杂一些,主要是C原子会通过sp3杂化形成4个等同的电子,所以出现4个成单电子,这样CO2分子中每个O原子都能与C原子形成两对共用电子对,还有两对孤对电子。
这样就不会将N2和CO2分子的电子写成如下形式:
对于CO分子,从下图示可知,除了有两对共用电子对外,还有一个配位键,O原子提供了一对孤对电子,C原子提供一个空轨道。

 方法/步骤21/2
方法/步骤21/24.离子化合img alt=怎样书写电子式 title=怎样书写电子式 = src=http://m.hxzxs.cn/images/%E8%AF%8D%E5%85%B8.png style=box-sizing: border-box; max-width: 100%; height: auto; vertical-align: middle; padding: 0px; margin: 0px 0px -2px;价电子式的书写要注意阳离子的外层电子不再标出,只在元素符号右上角标出正电荷,而阴离子则要标出外层电子,并加上方括号,在右上角标出负电荷。还要注意阴离子电荷总数与阳离子电荷总数相等,因为化合物本身是电中性的。
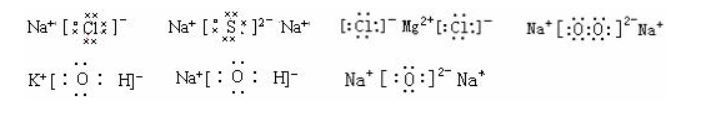 2/2
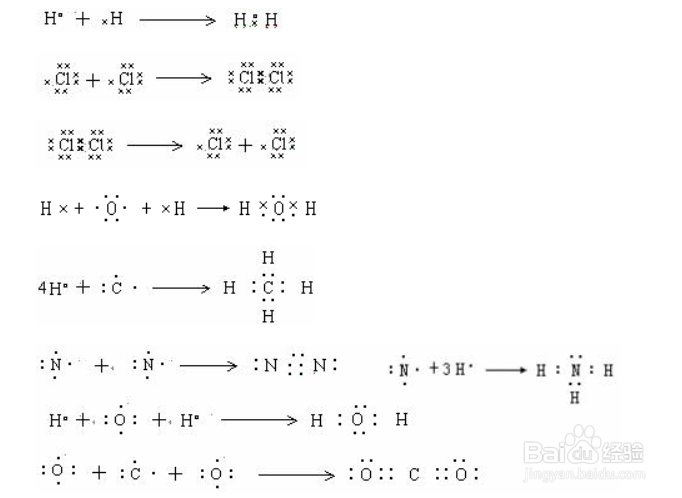
2/25.用电子式表示单质分子或共价化合物的形成过程
用电子式表示形成过程,左边要有反应物的原子的电子式,右边要有生成物的分子的电子式,中间用箭号连接。通过共价键形成的,原子一般有未成对电子,生成物要有共用电子对,不能有离子符号出现。
 方法/步骤31/1
方法/步骤31/16.用电子式表示离子化合物的形成过程
用电子式表示由离子键形成离子化合物过程,一定要在右边用阴阳离子来表示物质。
因此,用电子式表示形成过程,首先要弄清是通过离子键形成离子化合物,还是用共价键形成共价化合物和单质,然后才能按照各自的方法来书写电子式。

版权声明:
1、本文系转载,版权归原作者所有,旨在传递信息,不代表看本站的观点和立场。
2、本站仅提供信息发布平台,不承担相关法律责任。
3、若侵犯您的版权或隐私,请联系本站管理员删除。
4、文章链接:http://www.1haoku.cn/art_537500.html
 订阅
订阅