加水稀释为什么促进电离
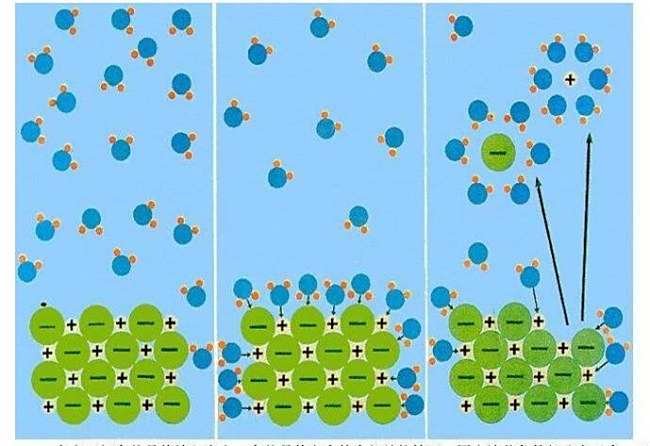
来源:网络收集 点击: 时间:2024-05-16醋酸是弱酸,部分电离,加水可以促进平衡向右移动,即促使未电离的醋酸分子继续电离。
虽然醋酸的电离程度在增大,但体积的增大占主要因素,c(H+)又是逐渐减小的。
醋酸溶于水后,能电离出醋酸根-和H+,同时醋酸根-和H+又结合成醋酸分子,这就是动态平衡。加水后,离子间距离变大,结合成分子的可能性变小。所以…
从另一个方面解释,电离平衡常数是溶液中的电离出来的各离子浓度乘积(c(A+)*c(B-))与溶液中未电离的电解质分子浓度(c(AB))的比值。它只与温度有关,一定温度下是常数!溶液稀释后。
比值变小(如稀释到一半浓度时,两种离子和醋酸分子的浓度都为1/2,它们的比值成了电离平衡常数的一半了)。而电离平衡常数只与温度有关,在温度不变下,为了达到电离平衡,醋酸分子继续电离,以使得它们比值增大到与电离平衡常数相等。
扩展资料:
凡是在水溶液或熔融状态下能够解离成阳离子与阴离子而导电的化合物叫电解质。例如酸、碱、盐、活泼金属氧化物、过氧化物、氢化物等。在水溶液或熔融状态下都不能导电的化合物叫非电解质。电解质和非电解质的区别就在于溶于水或熔融状态下能否导电。
离子化合物和某些具有极性的共价化合物在水溶液里全部电离为离子,没有分子存在,这样的电解质属于强电解质。强酸、强碱、大部分盐类都是强电解质。弱酸、弱碱、水等化合物在水溶液中部分电离成离子,存在电解质分子和离子之间的电离平衡,是弱电解质。电解质在溶剂中能否完全电离是区分强电解质和弱电解质的依据。
版权声明:
1、本文系转载,版权归原作者所有,旨在传递信息,不代表看本站的观点和立场。
2、本站仅提供信息发布平台,不承担相关法律责任。
3、若侵犯您的版权或隐私,请联系本站管理员删除。
4、文章链接:http://www.1haoku.cn/art_770618.html
 订阅
订阅