氨气燃烧化学方程式?
来源:网络收集 点击: 时间:2024-09-02【导读】:
在小朋友的认知范围内,最早了解氨气的常识是养鸡场而不是化学课中的实验制取,那时候知道氨气过多可以让小鸡们死亡,它的主要源头是鸡的粪便,那么氨气爆炸呢?工具/原料more试剂瓶/玻璃导管催化剂/干燥剂方法/步骤1/3分步阅读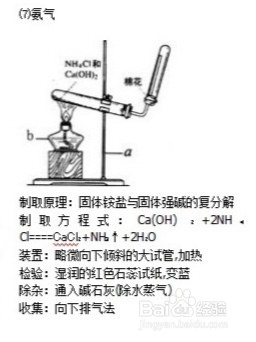
 2/3
2/3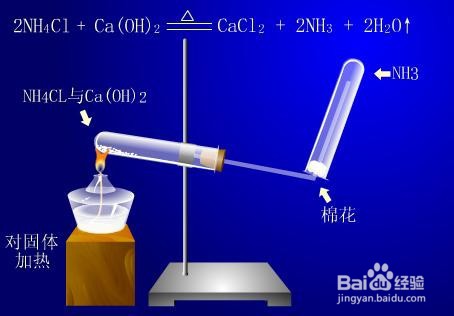 3/3
3/3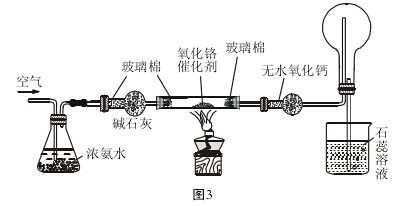 注意事项
注意事项
氨气(Ammonia),化学式为 NH3,是一种有强烈刺激性气味的无色气体。 密度 0.7710。相对密度0.5971(空气=1.00)。易被液化成无色的液体。在常温下加压即可使其液化(临界温度132.4℃,临界压力11.2兆帕,即112.2大气压)。沸点-33.5℃。也易被固化成雪状固体。熔点-77.75℃。溶于水、乙醇和乙醚。在高温时会分解成氮气和氢气,有还原作用。有催化剂存在时可被氧化成一氧化氮。用于制液氮、氨水、硝酸、铵盐和胺类等。可由氮和氢直接合成而制得,能灼伤皮肤、眼睛、呼吸器官的粘膜,人吸入过多,能引起肺肿胀,以至死亡。

 2/3
2/3氨气的制取
 3/3
3/3氨催化氧化和氨氧化燃烧不同,氨在O2中燃烧的方程式是:
4 NH3 + 3 O2 =2N2 +6 H2O
此反应的特点是,氨的氧化产物是N2而不是NO,氨也有爆炸极限,氨和空气混合,与引火源,可发生爆炸。
氨的催化氧化的氧化产物是NO,这催化剂的催化作用有关,两反应的机理不同,不可混为一谈。
 注意事项
注意事项氨催化氧化产物是NO和氨氧化燃烧产物是N2。
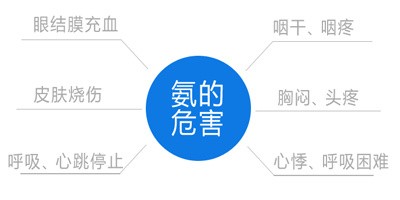
氨气能灼伤皮肤、眼睛、呼吸器官的粘膜,人吸入过多,能引起肺肿胀,以至死亡。
版权声明:
1、本文系转载,版权归原作者所有,旨在传递信息,不代表看本站的观点和立场。
2、本站仅提供信息发布平台,不承担相关法律责任。
3、若侵犯您的版权或隐私,请联系本站管理员删除。
4、文章链接:http://www.1haoku.cn/art_1190071.html
上一篇:家长对幼儿园老师的建议和意见怎么写
下一篇:山药玉竹鸭汤【美容养颜】
 订阅
订阅