求共价化合物的共用电子对数普遍公式!
来源:网络收集 点击: 时间:2024-04-10共用电子对数即为共价键的数量,我们设中心原子为A,n为共价键的个数。
公式为:n=1/2*(所有原子达到稳定结构时的最外层电子数-所有原子的价电子数)例:CO,套用公式得出,n=1/2*(16-10)=3,所以它的共价键就有3个。
共用电子对形成原因
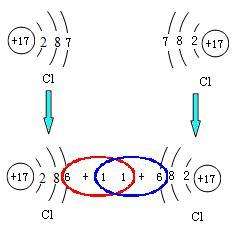
1、原子在最外层是8电子时是稳定结构(氢、氦除外),所以原子会尽量从外界获得电子以形成八电子稳定结构。
2、金属的失电子能力比较强,非金属的得电子能力比较强,所以他们结合就会直接得失电子形成离子。而得失电子能力差不多的元素相遇,它们不能直接进行电子的得失,所以就会各拿出一个或多个电子形成共用电子对。
3、每一个电子都同时属于两个原子,它在两个原子核外的空间运动,同时绕两个原子核运转,使原子的最外层有八个电子。而因原子核对电子吸引力的强弱而使电子对有所偏移。电子对偏向一方略显负电性,偏离一方略显正电。
扩展资料:
共价键的主要特点
1、饱和性
在共价键的形成过程中,因为每个原子所能提供的未成对电子数是一定的,一个原子的一个未成对电子与其他原子的未成对电子配对后,就不能再与其它电子配对,即,每个原子能形成的共价键总数是一定的,这就是共价键的饱和性。
2、方向性
除s轨道是球形的以外,其它原子轨道都有其固定的延展方向,所以共价键在形成时,轨道重叠也有固定的方向,共价键也有它的方向性,共价键的方向决定着分子的构形。
参考资料来源:
百度百科-共价键
百度百科-共用电子对
版权声明:
1、本文系转载,版权归原作者所有,旨在传递信息,不代表看本站的观点和立场。
2、本站仅提供信息发布平台,不承担相关法律责任。
3、若侵犯您的版权或隐私,请联系本站管理员删除。
4、文章链接:http://www.1haoku.cn/art_485170.html
 订阅
订阅